Fármacos antiepilépticos (FAEs)
Principios generales
- • El objetivo del tratamiento farmacológico es conseguir un óptimo control de la epilepsia con el menor número de efectos secundarios para obtener la máxima calidad de vida.
- • No existen muchos estudios que comparen los distintos FAEs disponibles en términos de eficacia.
- • Por ello, la elección del FAE se basará principalmente en el mecanismo de acción, la farmacocinética y el perfil de efectos adversos.
Mecanismo de acción y farmacocinética de los FAEs disponibles (Tabla I)
Tabla I. Fármacos antiepilépticos: mecanismo de acción y metabolismo.
FAE |
Mecanismo de acción |
Metabolismo |
Unión a proteínas |
Pico dosis |
T ½ eliminación |
CBZ |
Bloqueo canales NA+ |
Hepático (cit P450) |
75-85% |
4-8 h |
5-26 h |
CLB |
Agonista GABAa |
Hepático (cit P450) |
83% |
1-4 h |
10-50 h |
CNZ |
Agonista GABAa |
Hepático (cit P450) |
86% |
1-4 h |
20-80 h |
ESL |
Bloqueo canales NA+ |
Hepático (no cit P450) |
30% |
2-3 h |
20-24 h |
ESM |
Bloqueo canales CA2+ tipo T |
Hepático (cit P450) |
No |
4 h |
50-60 h |
GBP |
Bloqueo canales CA2+ |
Ninguno |
No |
2-4 h |
5-9 h |
LCM |
Bloqueo canales NA+ |
Hepático (no cit P450) |
15% |
4 h |
13 h |
LEV |
Fijación ptoteína SV2A |
Ninguno |
<10% |
1 h |
6-8 h |
LTG |
Bloqueo canales NA+ |
Hepático (no cit P450) |
55% |
1-3 h |
24-41 h |
OXC |
Bloqueo canales NA+ |
Hepático (cit P450) |
67% |
4-6 h |
8-10 h |
PB |
Agonista GABAa |
Hepático (cit P450) |
45-60& |
1-3 h |
75-120 h |
PGB |
Bloqueo canales CA2+ |
Ninguno |
No |
1 h |
6 h |
PHT |
Bloqueo canales NA+ |
Hepático (cit P450) |
70-95% |
4-12 h |
7-42 h |
RFN |
Bloqueo canales NA+ |
Hepático (no cit P450) |
30% |
4-6 h |
6-10 h |
RTG |
Bloqueo canales K+ |
Hepático (no cit P450) |
80& |
0,5-2 h |
6-10 h |
TGB |
Agonista GABAa |
Hepático (cit P450) |
96% |
1,5 h |
7-9 h |
TPM |
Múltiple |
Hepático (cit P450) |
15% |
2 h |
18-23 h |
VGB |
Acción GABAérgica |
Ninguno |
No |
2 h |
4-8 h |
VPA |
Múltiple |
Hepático (cit P450) |
85-95% |
1,5 h |
4-12 h |
ZNS |
Bloqueo canales CA2+ Múltiple |
Hepático (no cit P450) |
50% |
2-5 h |
60 h |
|
|||||
Pauta de tratamiento (Tabla II)
Tabla II. Pauta de tratamiento.
FAE |
Monoterapia |
Dosis inicio |
Incremento diario |
Mantenimiento (día) |
CBZ |
Sí |
100-200 mg c/12 h |
200 mg c/semana |
600-1.600 mg |
CLB |
Sí |
5-15 mg c/24 h |
5-15 mg c/semana |
20-40 mg (1-3 dosis) |
CNZ |
Sí |
0,25 mg c/24 h |
0,75 mg c/72 h |
0,5-4 mg (1-2 dosis) |
ESL |
No |
400 mg c/24 h |
400 mg c/1-2 semanas |
800-1.200 mg (1 dosis) |
ESM |
Sí |
250 mg c/24 h |
250 mg c/ 4-7 días |
750-2.000 mg (2 dosis) |
GBP |
Sí |
300 mg c/8 h |
300 mg c/2-3 días |
900-3.600 mg (3 dosis) |
LCM |
No |
50 mg c/12 h |
100 mg c/semana |
200-400 mg (2 dosis) |
LEV |
Sí |
250 mg c/12 h |
500 mg c/ 2 semanas |
1.000-3.000 mg |
LTG |
Sí |
25 mg c/24 h (si asoc. con VPA, 12,5 mg c/24 h) |
50 mg c/semana (si asoc. con VPA, 25 mg) |
100-200 mg (2-3 dosis) en monoterapia |
OXC |
Sí |
300 mg c/12 h |
600 mg c/semana |
600-2.400 mg (2 dosis) |
PB |
Sí |
50-100 mg c/24 h |
50-100 mg c/semana |
50-200 mg (1-2 dosis) |
PGB |
No |
75 mg c/12 h |
150 mg c/semana |
300-600 mg (2 dosis) |
PHT |
Sí |
100-150 mg c/12 h |
Ajustar por concentración plasmática |
200-500 mg (1-3 dosis) |
RFN |
No |
400 mg c/24 h |
400 mg c/48 h |
1.800-3.200 mg |
RTG |
No |
50-100 mg c/8 h |
150 mg c/semana |
600-1.200 mg (3 dosis) |
TGB |
No |
2,5-5 mg c/24 h |
5-15 mg c/semana |
15-50 mg (3 dosis) |
TPM |
Sí |
25 mg c/12 h |
50 mg c/semana |
100-400 mg (2 dosis) |
VGB |
Sí |
500 mg c/12 h |
500 mg c/semana |
2-3 g (2 dosis) |
VPA |
Sí |
200-500 mg c/12 h ("crono" c/24 h) |
200-500 mg c/2 semanas |
600-2.000 mg (2-3 dosis) ("crono" c/24 h) |
ZNS |
Sí |
25 mg c/12 h |
50-100 mg c/semana |
300-500 mg (1-2 dosis) |
Inicio de tratamiento
Consideraciones generales
El tratamiento con FAEs debe plantearse:
- • Ante un diagnóstico firme de epilepsia.
- • Para la elección del FAE adecuado, se debe intentar identificar el tipo de crisis y de epilepsia que presenta el paciente.
- • Si no es posible una correcta identificación del tipo de epilepsia, elegiremos un FAE de amplio espectro (levetiracetam, lamotrigina, topiramato, ácido valproico, zonisamida).
- • El tratamiento debe iniciarse en monoterapia con la dosis mínima eficaz.
- • En la elección del FAE más adecuado, consideraremos las características del paciente, los posibles fármacos que esté tomando el paciente y el que tenga menores efectos adversos.
¿Cuándo debe iniciarse?
- • Cuando se establezca el diagnóstico de epilepsia:
- ◗ Segunda crisis no provocada separada al menos 24 horas de la primera.
- ◗ Primera crisis no provocada y riesgo de recurrencia.
- • Se puede demorar el inicio de tratamiento en síndromes epilépticos concretos, que se pueden controlar evitando determinados factores precipitantes o modificando el estilo de vida.
Primera crisis no provocada
- • Riesgo de recurrencia del 40% (mayor en los 6 primeros meses y disminuye con el tiempo: 32% en ≥12 meses y 17% en ≥18 meses, con riesgo de recurrencia global a los 3 años del 78%).
- • El riesgo de recurrencia está determinado por:
- ◗ Etiología (daño cerebral estructural, exploración neurológica anormal, dificultades en el aprendizaje).
- ◗ EEG (descargas punta-onda generalizadas).
- ◗ Edad (< 16 años y > 60 años).
- ◗ Tipo de crisis y síndrome epiléptico (crisis focales y encefalopatías de la infancia).
- • Las posibilidades de remisión a largo plazo no se modifican por el inicio precoz del tratamiento.
- • El inicio de la terapia con un FAE reduce el riesgo de aparición de nuevas crisis mientras se mantenga dicho tratamiento.
Dos o más crisis no provocadas
- • Indicación de inicio de tratamiento.
- • El riesgo de recurrencia aumenta tras una segunda crisis (recidiva del 73%) o una tercera crisis (recidiva del 76%) no provocadas.
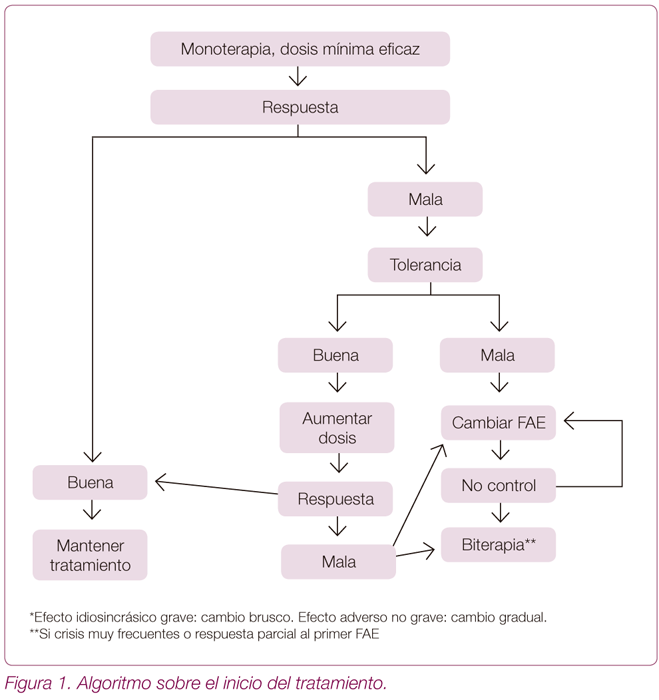
¿Cómo se debe iniciar? (Figura 1)
Retirada del tratamiento
Consideraciones generales
- • Debe realizarse de manera individualizada y de mutuo acuerdo con el paciente y/o la familia, considerando el síndrome epiléptico, el pronóstico y el estilo de vida.
- • De forma general, el 65-70% de pacientes permanecen libres de crisis con tratamiento farmacológico; el 30-50% de los pacientes controlados con tratamiento farmacológico son candidatos a la retirada del FAE, sin que vuelvan a recurrir las crisis en los siguientes 5 años(1).
- • La retirada de medicación se puede considerar en pacientes en monoterapia sin crisis en los dos-tres primeros años, que presenten factores de buen pronóstico: pocas crisis antes de iniciar el tratamiento, respuesta inicial a monoterapia, exploración y pruebas complementarias normales (RM y EEG)(2).
- • El tratamiento farmacológico puede ser indefinido en epilepsias con alto índice de recurrencias como por ejemplo pacientes con epilepsia mioclónica juvenil, lesiones estructurales epileptógenas u otros síndromes asociados a epilepsia de difícil control.
Riesgo de recurrencia
- • Las recurrencias tras la retirada farmacológica suelen ocurrir en los 6 primeros meses en un 50% de los casos y antes del año en un 80%.
- • En los dos años siguientes al inico de la retirada del FAE, un 59% de los pacientes permanece libre de crisis.
- • Factores relacionados con el riesgo de recurrencia(3):
- ◗ Crisis mioclónicas, crisis tónico-clónicas, diferentes tipos de crisis en un paciente.
- ◗ Determinados síndromes epilépticos (epilepsia mioclónica juvenil, epilepsia de ausencias juveniles, epilepsia de la lectura, encefalopatías de la infancia).
- ◗ Déficits neurológicos o retraso en el aprendizaje.
- ◗ Epilepsia sintomática.
- ◗ Etiología progresiva.
- ◗ EEG con descargas punta-onda generalizadas.
- ◗ Aparición de crisis tras el inicio del tratamiento.
- ◗ Necesidad de politerapia.
- ◗ Breve duración del periodo libre de crisis antes de la retirada.
- ◗ Intentos previos de retirada, con recurrencia de crisis.
Cómo retirar el tratamiento
- • En general, si el paciente recibe tratamiento con monoterapia, se recomienda retirar el fármaco de manera gradual en un tiempo mínimo de 2-3 meses.
- • En politerapia la retirada se hará de manera fraccionada: primero se suspenderá el fármaco con menor eficacia o el que esté produciendo mayores efectos secundarios y, por último, aquel que haya conseguido el control definitivo de las crisis.
- • En caso de tratamiento con benzodiazepinas o barbitúricos, la retirada brusca puede producir crisis por deprivación. Se aconseja una retirada gradual durante al menos 6 meses.
- • En caso de recurrencia de crisis, se volverá a administrar de nuevo el fármaco a la dosis prescrita previamente; en estos casos se obtiene un respuesta satisfactoria en el 90% de los pacientes.
Tratamiento de las crisis sintomáticas agudas/asociadas a
situaciones concretas
Crisis sintomáticas agudas
- • Inicialmente, se recomienda el tratamiento específico de la causa que produjo la crisis.
- • Ante crisis recurrentes puede ser necesario el uso de FAEs hasta que se solucione la causa desencadenante.
- • Las crisis ocasionadas por supresión de alcohol suelen aparecer en las primeras 12-24 horas y se tratan con benzodiazepinas intravenosas durante el periodo agudo. No se recomienda tratamiento profiláctico secundario.
Profilaxis de crisis asociadas a situaciones concretas
- • Tras TCE graves (primeras 2 semanas) con riesgo de crisis sintomáticas agudas que empeorarían el pronóstico del propio TCE.
- • En pacientes con HSA por rotura de aneurisma, en la fase aguda, para evitar la posibilidad de resangrado tras una crisis.
Respuesta esperada a fármacos
- • Con tratamiento farmacológico, un 70% de los pacientes presenta un control adecuado de sus crisis epilépticas.
- • Libertad de crisis: ausencia de cualquier tipo de crisis, incluidas las auras, durante 12 meses o durante un tiempo al menos tres veces superior al intervalo más largo sucedido entre crisis en el año previo al inicio del tratamiento.
- • El mayor índice de respuestas se observa con el primer FAE (42-47%) y con el segundo(1,4).
Epilepsia refractaria o farmacorresistente
- • Definición: epilepsia que no ha logrado una evolución libre de crisis tras tratamiento con dos FAEs en monoterapia o en asociación, apropiados al tipo de epilepsia y tomados de forma adecuada(5).
- • El diagnóstico de epilepsia refractaria o resistente a fármacos aconseja la evaluación del paciente en una Unidad de Epilepsia con monitorización vídeo-EEG (VEEG) con el fin de asegurar el diagnóstico de epilepsia, tipo de epilepsia y selección de tratamiento adecuado. Considerar, además, la posibilidad de falta de adherencia al tratamiento farmacológico del paciente.
Monoterapia vs politerapia
Monoterapia
- • Tratamiento de inicio.
- • Es eficaz en la mayoría de casos.
- • Mejora el cumplimiento terapéutico.
Politerapia
Se debe considerar en los siguientes casos:
- • No hay respuesta tras dos intentos de monoterapia.
- • Elevada frecuencia de crisis sin respuesta a un primer FAE.
- • Respuesta parcial a dosis máximas de un primer FAE.
Ventajas
- • Permite combinar diferentes mecanismos de acción farmacológicos.
- • Permite dar dosis inferiores de cada FAE para minimizar el riesgo de toxicidad e interacciones farmacológicas.
Inconvenientes
- • Incremento del número de formulaciones.
- • Dificulta el cumplimiento terapéutico.
- • Puede aumentar el riesgo de los efectos secundarios.
Selección de fármacos
- • Considerar las características del sujeto (edad, sexo, comorbilidades, politerapia con otros fármacos) cuando se eligen los FAEs que se van a combinar.
- • Generalmente se combinan entre 2-3 FAEs. Un mayor número de FAEs no suele ser más eficaz y se asocia a un mayor riesgo de efectos secundarios.
- • Selección de los FAEs en politerapia:
- ◗ Elegir FAEs eficaces para el tipo de síndrome epiléptico y de crisis que presenta en el paciente.
- ◗ Elegir aquéllos con menos efectos secundarios y sin toxicidad aditiva sobre los FAEs que ya reciba el paciente.
- ◗ Evitar asociaciones en las que existe un mayor riesgo de interacciones farmacocinéticas/farmacodinámicas que puedan reducir la eficacia de la politerapia y aumentar el riesgo de efectos adversos.
- ◗ Se aconsejan mecanismos de acción complementarios.
Combinaciones de fármacos(7-10)
- • Aunque, desde el punto de vista teórico, sería posible hacer muchas combinaciones de fármacos antiepilépticos, no todas ellas son igual de beneficiosas y, desafortunadamente, existen pocos ensayos clínicos que nos dirijan a la hora de elegir las posibles combinaciones de FAEs.
- • Las combinaciones que realizamos en la práctica clínica diaria se basan en la experiencia adquirida, en el resultado de metaanálisis y en la politerapia "racional": combinación de FAEs con mecanismos de acción diferentes.
- • Las combinaciones de FAEs documentadas/especulativas más beneficiosas se resumen en la Tabla III.
- • La combinación LTG+VPA tanto para crisis parciales como generalizadas y la de VPA+ESM para el tratamiento de las ausencias son algunas de las combinaciones beneficiosas mejor documentadas.
Tabla III. Asociaciones sinérgicas de FAEs, documentadas y especulativas.
|
Asociaciones
|
Indicaciones |
Comentario |
|
VPA+LTG |
Ausencias Focal Lennox-Gastaut Mioclonías
|
Aumenta eficacia Eficacia documentada Introducir lentamente el segundo FAE El VPA puede aumentar los niveles de LTG Mayor riesgo de exantemas por LTG y temblor por VPA |
|
VPA+ESM |
Ausencias
|
Eficacia documentada Mecanismos múltiples El VPA aumenta levemente en nivel de ESM y la ESM reduce levemente el de VPA |
|
CBZ/OXC+VPA |
Focal Generalizadas TC |
Documentada. Amplia experiencia. Escasos ensayos. Debe evitarse en mujeres en edad fértil (mayor riesgo de efectos teratógenos) |
|
LTG+TPM |
Focal Generalizada Lennox-Gastaut |
Documentada Amplio espectro. |
|
VPA+STP+CLB |
Síndrome de Dravet |
Documentada |
|
VPA+TPM
|
Focal Generalizada |
Anecdótica El TPM puede provocar reducción de peso y el VPA aumenta el apetito |
|
LTG+GBP |
Focal |
Anecdótica |
|
CBZ/OXC + TPM |
Focal |
Anecdótica |
|
LTG/VPA+LEV/ZNS |
Focal Generalizada |
Especulativa Amplio espectro |
|
CBZ/LTG/OXC/VPA+GBP/LEV/PGB/ZNS |
Focal |
Especulativa Diversos mecanismos de acción |
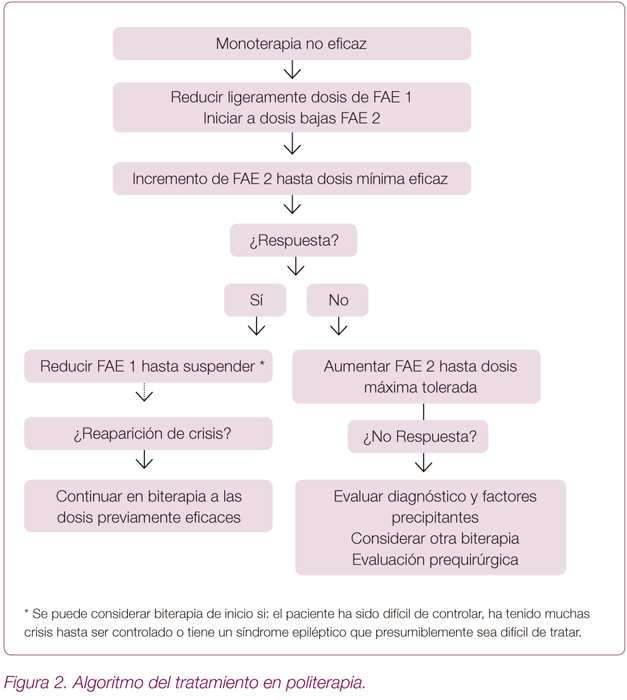
Inicio de politerapia (Figura 2)
Selección del fármaco antiepiléptico
La elección de un fármaco en mono o politerapia depende de:- • Tipo de crisis y síndrome epiléptico.
- • Características individuales del paciente.
- • Características farmacocinéticas/farmacodinámicas del fármaco.
- • Posibilidad de efectos adversos.
- • Preferencias del paciente.
Tipo de crisis y síndrome epiléptico
La elección de un FAE depende de su efectividad en el tipo de crisis epiléptica que tenga el paciente (Tabla III)(8,11-13).
Tabla III. Eficacia de los FAEs según el tipo de crisis.
|
FAE |
Parciales y secund., generalizadas |
Generalizadas tónico-clónicas |
Ausencias |
Mioclonías |
Atónicas/ átonas |
|
CBZ |
+ |
+ |
- |
- |
- |
|
CLB/CZP |
+ |
+ |
¿+? |
+ |
+ |
|
ESL |
+ |
¿? |
¿? |
¿? |
¿? |
|
ESM |
0 |
0 |
+ |
¿+? |
0 |
|
PHT |
+ |
+ |
- |
- |
- |
|
GBP |
+ |
¿+? |
- |
- |
0 |
|
LCM |
+ |
¿+? |
¿? |
¿? |
¿? |
|
LTG |
+ |
+ |
+ |
+ () |
+ |
|
LEV |
+ |
+ |
¿+? |
+ |
¿? |
|
OXC |
+ |
+ |
- |
- |
- |
|
PB/PRM |
+ |
+ |
0 |
¿+? |
¿+? |
|
PGB |
+ |
¿+? |
¿? |
¿? |
¿? |
|
RTG |
+ |
¿? |
¿? |
¿? |
¿? |
|
RFN |
+ |
0 |
¿? |
¿? |
+ |
|
TGB |
+ |
- |
- |
- |
0 |
|
TPM |
+ |
+ |
¿+? |
+ |
+ |
|
VGB |
+ |
¿+? |
- |
- |
¿? |
|
VPA |
+ |
+ |
+ |
+ |
+ |
|
ZNS |
+ |
+ |
+ |
+ |
¿+? |
+=Eficaz. ¿+?=Probablemente eficaz. 0=ineficaz. -= empeoramiento de las crisis epilépticas. ()= descrito empeoramiento en algunos pacientes. ¿?=desconocido. Secund.: secundariamente.
Síndrome epiléptico
Ver el apartado de "Síndromes epilépticos" del capítulo de "Clínica".
Características individuales del paciente
Según edad
Niños(14-16)
- • La epilepsia en la infancia se caracteriza por tener un mayor número de tipos de crisis y síndromes epilépticos.
- • En un grupo de pacientes la respuesta al tratamiento puede estar influenciada por la prontitud con la que se inicia.
- • La elección del FAE está marcada por:
- ◗ El tipo de síndrome que presenta cada niño (Tabla IV). Ver el apartado de "Síndromes epilépticos" del capítulo de "Clínica".
Tabla IV. Tratamientos recomendados según síndromes epilépticos en el niño.
S. Epiléptico |
FAE inicial |
Otros FAE |
FAE a evitar |
S. de West E. Tuberosa |
VGB |
ACTH |
|
Resto S. West |
ACTH |
VGB, corticoides |
|
S. Lennox-Gastaut |
VPA |
LTG, RFM, TPM, BZD |
PHT, CBZ |
Epilepsia-ausencia infantil y juvenil |
VPA, LTG |
ESM |
CBZ/OXC, PTH. FB, TGB, VGT |
E. mioclónica juvenil |
VPA |
LTG, LEV, TPM, ZNS, CZP |
CBZ/OXC, PTH, GBP, TGB, VGB |
E. rolándica-benigna |
Ninguno |
CBZ/OXC, VPA, LTG |
|
- ◗ Factores del propio paciente:
- Cuanto más pequeño sea el niño, sería recomendable evitar fármacos con potencial efecto negativo sobre la capacidad cognitiva (fenitoína, primidona, clobazam, clonazepam, topiramato, fenobarbital…)
- En mujeres adolescentes, hay que tener precaución con el ácido valproico, sobre todo ante el posible riesgo de síndrome de ovario poliquístico y cambios estéticos indeseables. No obstante, en esta población se puede emplear el ácido valproico a dosis más bajas, siendo generalmente suficiente.
- ◗ Características farmacocinéticas y farmacodinámicas del antiepiléptico:
- La dosis necesaria (mg/Kg) es mayor que en el adulto, por lo que la dosis se debe ajustar al peso y titularse lentamente.
- Es recomendable iniciar la medicación en la toma de la noche e ir haciendo ascensos cada 3-7 días.
- Debe facilitarse a los familiares canuletas de diazepam rectal (5-10 mg) por si aparece una crisis.
- Las recomendaciones para el tratamiento en politerapia son similares a las referidas anteriormente. En general, debe intentarse un tratamiento con 2 o 3 fármacos en monoterapia antes del inicio de la politerapia.
- La supresión del tratamiento se realizará de forma individualizada, aunque puede considerarse:
a) A los 2-3 años sin crisis (focales idiopáticas/ausencias típicas).
b) A los 5 años en las crisis parciales sintomáticas.
c) A los 10 o más años en la epilepsia mioclónica juvenil.
Ancianos
- • En general, se considera que la epilepsia en el anciano es la que empieza por encima de los 65 años.
- • El 70% de las crisis del anciano son de inicio focal.
- • La mayoría de las epilepsias en el anciano son sintomáticas, por lo que el riesgo de recurrencia es alto (80%).
- • A diferencia de otros grupos de edad, es más frecuente que los pacientes presenten otras comorbilidades y estén polimedicados, siendo más frecuentes las posibles interacciones farmacológicas y los efectos secundarios.
- • En esta franja de edad, las epilepsias suelen ser más fáciles de tratar y generalmente responden a dosis más bajas de FAEs.
- • Al igual que en otros grupos de edad, el objetivo inicial es la monoterapia.
- • En la selección del FAE más adecuado, se debe evitar FAEs con efectos neurocognitivos y con mayor riesgo de interacciones farmacológicas.
- • Los efectos secundarios son frecuentes, especialmente los neurotóxicos, también es frecuente la variabilidad farmacocinética, por lo que a veces es difícil predecir la dosis óptima (especialmente en los fármacos que se unen a proteínas plasmáticas).
- • Para mejorar la tolerancia, como guía general, puede comenzarse con la mitad de la dosis inicial del adulto joven y realizar incrementos más lentos, sobre todo en el caso de CBZ.
- • Como existe un mayor potencial de toxicidad, es recomendable una reducción de las dosis total de un 20% respecto a un adulto.
Efectos secundarios de especial relevancia en el anciano(19):
- • Alteraciones cognitivas: fenitoína, fenobarbital, topiramato, benzodiazepinas, primidona, valproico.
- • Trastornos extrapiramidales: valproico, fenitoína.
- • Trastornos de la conducción cardiaca: fenitoína iv, carbamazepina, lamotrigina.
- • Hiponatremia: carbamazepina, oxcarbazepina, fenitoína.
- • Efectos sobre el peso: valproato, carbamazepina, gabapentina, pregabalina, zonisamida, topiramato.
Tratamiento farmacológico y mujer
La administración del tratamiento antiepiléptico en la mujer, sobre todo en edad fértil, implica el conocimiento de algunas circunstancias especiales relacionadas con el ciclo menstrual y las hormonas sexuales.
Aunque no se conoce bien el mecanismo, se piensa que los estrógenos tienen cierto efecto promotor de crisis, mientras que la progesterona tiene cierto potencial inhibidor de las crisis epilépticas.
Embarazo
La mayoría de las pacientes con epilepsia tendrán un embarazo y parto normal, y darán a luz a un niño sano.
En el 67% de las mujeres con epilepsia el número de crisis no se modifica durante el embarazo, aumenta en el 17% y disminuye en el 16%(20).
- • Consideraciones generales(21):
- ◗ El embarazo de una paciente con epilepsia debe de ser planificado con su médico.
- ◗ En epilepsias controladas de años de evolución sin factores de mal pronóstico asociados, se puede planificar simplificar/suspender el tratamiento durante el año previo al posible embarazo. Si no se puede suspender el tratamiento, el objetivo es la monoterapia con la dosis mínima eficaz.
- ◗ Evitar cambios mayores de medicación incluso si la mujer se queda embarazada sin haberlo planificado.
- ◗ Se recomienda control clínico y de niveles plasmáticos en el momento del diagnóstico, principio de cada trimestre e inicio del último mes de embarazo, individualizando según necesidades.
- ◗ Aunque es controvertido, se recomienda tomar 5 mg de fólico al día para prevenir malformaciones del tubo neural.
- ◗ Durante el embarazo se producen cambios metabólicos que pueden alterar la farmacocinética de algunos FAEs. FAEs como lamotrigina y oxcarbazepina pueden ver reducidos sus niveles por lo que puede ser necesario monitorizar los niveles de algunos FAEs y reajustar la dosis si es necesario.
- • Efectos teratógenos:
- ◗ De forma general, la monoterapia se asocia a un menor riesgo de teratogénesis que la politerapia (4% a 6% frente a 6%-17%)(20,22).
- ◗ Con cualquier FAE existe mayor riesgo de malformaciones a mayor dosis.
- ◗ Mayor riesgo de malformaciones si hay historia familiar de malformaciones.
- ◗ En base a los registros internacionales, los FAEs con menor riesgo de teratogeneicidad son lamotrigina y carbamazepina.
- ◗ El riesgo de malformaciones es similar al de la población general cuando se emplean dosis de carbamazepina <400 mg/día y dosis de lamotrigina < 200-300 mg/día.
- ◗ El ácido valproico se asocia a un mayor riesgo de teratogeneicidad si se emplea en politerapia y/o a dosis >700-800 mg día.
- ◗ El ácido valproico se puede asociar a un cociente intelectual menor en niños de embarazadas que lo tomaron durante el embarazo.
- ◗ Algunos estudios indican que el topiramato se asocia a un mayor riesgo de malformaciones.
- ◗ Aunque no existe suficiente evidencia, levetiracetam podría asociar un riesgo bajo de malformaciones.
- ◗ Algunos FAEs se asocian a malformaciones más específicas:
- Valproato: defectos del tubo neural, labio leporino, paladar hendido.
- Carmabacepina y fenitoína: paladar hendido.
- Fenobarbital: malformaciones cardiacas(23).
Lactancia
- • La lactancia no está contraindicada en las pacientes epilépticas que toman FAEs.
- • Todos los antiepilépticos pasan a la leche materna en cantidad variable y su concentración en el recién nacido se relaciona además con la maduración del metabolismo del recién nacido.
- • Se recomienda vigilar la ganancia ponderal del recién nacido y las posibles alteraciones del ciclo sueño-vigilia.
Anticonceptivos orales
- • Reducción de la eficacia de los anticonceptivos orales con los inductores enzimáticos (fenitoina, fenobarbital, carbamazepina, primidona, oxcarbazepina), y topiramato >400 mg/día.
- • Los anticonceptivos orales pueden reducir los niveles de lamotrigina con riesgo de recurrencia de crisis. Además, existe riesgo de intoxicación en la semana en la que la mujer no toma anticonceptivo.
- • Se recomienda usar anticonceptivos con al menos 50 mcg de estrógenos si se usan FAEs inductores enzimáticos.
- • Acotar el intervalo de administración de medroxiprogesterona IM si se usan inductores enzimáticos.
Síndrome ovario poliquístico (SOPQ)
- • El SOPQ es una endocrinopatía frecuente, con una incidencia del 2-5% entre las mujeres en edad fértil. Es la causa más frecuente de infertilidad anovulatoria.
- • La prevalencia de SOPQ en mujeres con epilepsia es mayor, aunque no tomen FAEs. Aumenta si el tratamiento es con VPA, fundamentalmente si su instauración es por debajo de los 20 años.
- • El SOPQ es reversible una vez que se retira el ácido valproico.
- • Se recomienda realizar revisiones ginecológicas periódicas.
Epilepsia catamenial
- • El término de "epilepsia catamenial" se refiere a la exacerbación de las crisis en relación al ciclo menstrual.
- • Es controvertido su manejo.
- • Algunos autores hablan de mejoría con tratamiento no antiepiléptico como progesterona, análogos de la GnRH y antiestrógenos. En otros estudios se reportan resultados positivos con acetazolamida y clobazam cuando se administran perimenstrualmente.
Comorbilidad
Pacientes con síndrome depresivo
- • El síndrome depresivo es un trastorno relativamente frecuente en pacientes con epilepsia(24).
- • La mayoría de los FAEs se pueden emplear en pacientes con epilepsia de forma segura. No obstante hay fármacos antidepresivos que pueden favorecer las crisis al disminuir el umbral convulsivo (Tabla V).
- • Hay FAEs que mejoran o estabilizan el estado de ánimo: lamotrigina, carbamazepina y ácido valproico.
Tabla V. Riesgo de los antidepresivos de producir crisis epilépticas.
|
Riesgo alto |
Riesgo medio |
Riesgo bajo |
Riesgo muy bajo |
|
Bupropion (DA) |
Bupropion (DM, DB) |
Imipramina |
Sertralina |
|
Clorimipram (DA) |
Clorimipram (DM, DB) |
Venlafaxina |
Citalopram |
|
Maprotilina (DA) |
Maprotilina (DM, DB) |
Fluoxetina |
Escitalopram |
|
Amoxapina (DA) |
Fluvoxamina |
Paroxetina |
|
|
|
Imipramina (DA, DM) |
Mirtazapina |
|
|
|
|
Reboxetina |
|
|
|
|
Trazodona |
|
|
|
|
IMAOs |
|
DA: Dosis altas. DM: Dosis media. DB: Dosis baja. IE: Inductores enzimáticos
- • En pacientes susceptibles, cualquier FAE puede desencadenar la aparición de síntomas depresivos y de ansiedad. Esta asociación esta tanto más frecuente en pacientes con antecedentes personales y/o familiares de síndrome depresivo y se describe con mayor frecuencia con algunos FAEs: topiramato, levetiracetam, fenobarbital, y vigabatrina.
- • Los FAEs inductores enzimáticos pueden disminuir la eficacia de los fármacos antidepresivos, siendo a veces necesario reajustar la dosis del antidepresivo.
- • Fluoxetina y fluvoxamina inhiben el citocromo y aumentan carbamazepina.
Epilepsia y trastornos psicóticos
- • Aproximadamente el 10% de los epilépticos precisan tratamiento antipsicótico. Algunos de ellos, solamente de forma puntual, pero hay un grupo de pacientes que precisan esta medicación de forma crónica.
- • Muchos fármacos antipsicóticos se pueden emplear de forma segura en pacientes con epilepsia. No obstante, existe un grupo de antipsicóticos que se asocian a un mayor riesgo de presentar crisis (Tabla VI).
- • Los FAEs inductores enzimáticos pueden disminuir la eficacia de los neurolépticos por lo que puede ser necesario reajustar la dosis.
- • La CBZ puede aumentar la toxicidad por litio.
- • Es conveniente evitar la asociación clozapina+carbamazepina por aumentar el riesgo de alteraciones hematológicas (aplasia medular)(25).
- • FAEs como lamotrigina, oxcarbazepina y ácido valproico pueden tener efectos beneficiosos en el manejo del paciente psicótico.
- • FAEs como topiramato, levetiracetam, vigabatrina y fenitoina se han asociado con brotes psicóticos(26). No obstante, este efecto adverso no es exclusivo de estos FAEs y es posible encontrarlo con otros fármacos en pacientes susceptibles.
Tabla VI. Riesgo de producir crisis epilépticas con la administración de antipsicóticos.
|
Riesgo Alto |
Riesgo Medio |
Riesgo Bajo |
|
Clorpromazina (DA) |
Clorpromazina (DM, DB) |
Risperidona |
|
|
Clozapina (DM) |
Haloperidol |
|
Clozapina (DA, DM) |
Olanzapina |
Quetiapina |
|
|
|
Trifluoperazina |
|
|
|
Pimozide |
|
|
|
Flufenazina |
DA: Dosis Altas. DM: Dosis Media. DB: Dosis Baja
Otras enfermedades(26-29)
Los pacientes epilépticos pueden tener otras enfermedades o situaciones especiales que deben tenerse en cuenta a la hora de seleccionar un FAE (Tabla VII).
Tabla VII. Recomendaciones para el uso de FAEs en pacientes con epilepsia y otra comorbilidad.
|
Comorbilidad |
FAE recomendables |
Uso con precaución, |
|
Cardiopatía |
LEV, LTG, TPM, VPA, ZNS, GBP |
CBZ, OXC, PGB, PHT, RTG, LCM |
|
Enfermedad pulmonar |
GBP, LEV, LTG,OXC, PGB, TPM, VPA, ZNS |
CBZ, BZP, FB, PRM |
|
Insuficiencia hepática |
LEV, OXC, PGB, GBP, TPM, LCM, ESL |
FAEs metabolismo hepático (LTG, VPA, BZP, PHT, FB, CBZ, PRM, ZNS) |
|
Insuficiencia renal o hemodiálisis |
PHT, VPA, BZP, ESM, TGB, CBZ, RTG |
FAEs sin unión o con poca unión a proteínas: GBP, LEV, LTG, OXC, FB, PGB, PRM, TPM, ZNS |
|
Porfiria |
LEV, OXC, PGB, GBP |
BZP, CBZ, LTG, FB, PHT, PRM, TGB, TPM, VPA, ZNS |
|
Cáncer |
GBP, LTG, LEV |
Evitar IE |
|
Hipotiroidismo |
BZP, GBP, LEV, LTG, PB, ZNS |
OXC, TPM, VPA, CBZ, FB, PHT, PRM |
|
Trasplante de médula ósea |
GBP, LEV, LTG, TPM
|
CBZ, OXC, FB, PRM, VPA |
|
VIH (con TARGA) |
LEV, PGB,TPM, GBP |
BZP, LTG, OXC, VPA, ZNS, CBZ, FB, PHT, PRM |
|
Hipersensibilidad a FAEs |
GBP, LEV, PGB,TPM, VPA |
CBZ, PHT, LTG |
|
Osteoporosis |
LEV, LTG,PGB,ZNS,GBP, BZP, |
VPA, CBZ, FB, PHT, PRM |
|
Retraso mental |
LEV, LTG,OXC,VPA, GBP |
PGB, ZNS, CZP, FB, PHT, TPM |
|
Deterioro cognitivo |
LTG, GBP |
CBZ, OXC, PHT, BZP, FB, PHT, PRM, TPM |
|
Tumor cerebral |
LEV, VPA, GBP, PGB, ZNS, LCM |
CBZ, PHT, TPM, VPA, BZP, FB, PRM |
|
Obesidad |
TPM, ZNS |
CBZ, GBP, PGB, VPA |
|
Migraña |
TPM, VPA, ZNS, LTG |
|
|
Ansiedad |
GBP, PGB, CLB, VPA |
LEV |
|
Insomnio |
CBZ, GBP, PGB, LEV, TPM |
LTG |
|
Hiponatremia |
----- |
CBZ, OXC |
|
Disfunción urinaria |
----- |
RTG |
|
Cálculos renales |
----- |
TPM, ZNS |
|
SPI/MPP |
GBP |
--- |
|
Rash/alergia cutánea |
VPA, BZP, LEV |
CBZ, OXC, LTG PHT |
|
Depresión |
LTG, OXC, PGB, VPA,CBZ |
FB, PHT, PRM, TGB, TPM |
|
Trastornos psicóticos |
LTG, OXC, VPA |
ESM, LEV, TPM |
SPI: Síndrome de piernas inquietas. MPP: Movimientos periódicos de las piernas. IE: Inductores enzimáticos. TARGA: Terapia antirretroviral de gran actividad.
Tabla adaptada de Serrano-Castro Pj et al. Antiepileptic treatment in patients with epilepsy and other comorbidities (Seizure 19 (2010) 375–382).
* La decisión de tratamiento debe individualizarse en cada paciente.
**Algunas de las recomendaciones se basan en evidencia clase IV (Recomendaciones de expertos).
*** El orden expuesto de los FAEs en la tabla no significa que esté más o menos recomendado.
**** Evidencia limitada e insuficiente de algunos nuevos FAEs para recomendar/desaconsejar su uso en diferentes patologías.
Efectos secundarios de los FAEs
- • Comunicados por más del 50% de los pacientes(30).
- • 10-30% de los pacientes suspenden el primer FAE por efectos adversos.
- • Difieren de fármaco a fármaco.
- • Pueden empeorar la calidad de vida tanto como las crisis.
- • Frecuentemente son infradiagnosticados.
- • Condicionan con frecuencia el fármaco a seleccionar.
Clasificación de los efectos adversos
- • Tipo A: relacionados con el mecanismo de acción.
- • Tipo B: idiosincráticos.
- • Tipo C: crónicos o efectos tardíos
- • Tipo D: teratogénicos y carcinogénicos.
- • Tipo E: interacciones farmacológicas (farmacocinéticas o fármacodinámicas).
Relacionados con el mecanismo de acción (tipo A)
- • Frecuentes, comunes a muchos FAEs, predecibles.
- • Dosis dependientes, reversibles.
- • Suelen aparecer de forma aguda a los minutos de la toma del FAE.
- • Relacionados con la dosis administrada y la velocidad de escalado.
- • Más frecuentes en ancianos, en pacientes con politerapia y con otras enfermedades.
- • Los efectos adversos más comunes son:
- ◗ Molestias gástricas: más frecuente con ácido valproico + lamotrigina.
- ◗ Ataxia: fenitoína, carbamazepina, fenobarbital.
- ◗ Efectos cognitivos (bradipsiquia): más frecuente con fenitoína, carbamazepina, fenobarbital, benzodiazepinas, topiramato, pregabalina.
- ◗ Alteración del lenguaje: topiramato, zonisamida.
- ◗ Otros (Tabla VIII).
Tabla VIII. Reacciones dosis-dependientes relacionadas con FAEs individuales.
|
Arritmias |
CBZ, PHT |
|
Hiponatremia |
CBZ, OXC |
|
Acidosis metabólica, parestesias, oligohidrosis |
ZNS, TPM |
|
Macrocitosis, anemia |
CBZ, PHT, FB |
|
Temblor |
VPA |
|
Leucopenia |
CBZ, PHT |
|
Trombocitopenia, alteración de la función plaquetaria |
VPA |
|
Insomnio |
LTG |
Reacciones adversas idiosincrásicas (tipo B)
- • No predecibles.
- • No relacionadas con el mecanismo de acción del FAE y sí con la vulnerabilidad individual.
- • Múltiples mecanismos involucrados. Más vulnerables pacientes en edades pediátricas y ancianos, pacientes con enfermedades inmunológicas, infecciones, y errores congénitos del metabolismo.
- • Se disminuye el riesgo, si el FAE se administra a dosis bajas, y se va aumentando lentamente.
- • Aunque algunos FAEs se relacionan más específicamente con algunas reacciones adversas, cualquier FAE potencialmente puede producir un efecto adverso idiosincrásico.
Reacciones cutáneas
- • La Tabla IX muestra los FAEs que se relacionan con más frecuencia con reacciones cutáneas.
- • La mayoría de las reacciones cutáneas son leves y reversibles, no obstante, este efecto adverso puede ser más grave y producir un síndrome de Stevens-Johson o síndromes de hipersensbilidad más graves con afectación multisistémica (fiebre, rash, adenopatías y fallo multiorgánico).
- • Pueden aparecer meses después de iniciado el tratamiento.
- • Los FAEs asociados con más frecuencia a reacciones cutáneas son PHT (10%), CBZ (8,7%) y LTG (6,2%).
- • Mayor riesgo si escalado rápido y antecedentes de rash con otros fármacos.
- • Mayor riesgo en pacientes que toman VPA y se añade LTG (en estos pacientes el escalado de dosis de LTG debe ser más lento que si se diera de forma individual la LTG).
- • Un 30% de pacientes que tuvieron rash con CBZ lo tendrán también con OXC.
- • Ante una reacción cutánea hay que:
- ◗ Suspender el FAE inmediatamente.
- ◗ Emplear benzodiazepinas hasta que se resuelva la reacción cutánea. Es controvertido el uso de corticoides.
- ◗ Emplear a continuación FAEs con menor riesgo de reacción cutánea.
Tabla IX. Riesgo de rash cutáneo con FAEs.
|
Riesgo alto |
Riesgo moderado |
Riesgo bajo |
|
PHT |
OXC |
LEV |
|
LTG |
TGB |
GBP |
|
CBZ |
ZNS |
VPA |
|
|
PB |
FBM |
|
|
CLB |
TPM |
|
|
|
VGB |
|
|
|
PRM |
Hepatotoxicidad
- • Reacción adversa infrecuente más descrita con ácido valproico y en menor medida con felbamato.
- • Son factores de riesgo para hepatoxicidad: niños menores de dos años, politerapia con FAEs inductores, enfermedad hepática previa y errores congénitos del metabolismo.
- • Los análisis rutinarios del perfil hepático no siempre predicen este tipo de efecto adverso. La elevación de la GGT/GPT/GOT/amonio es dosis dependiente y no indica un riesgo más elevado de este tipo de reacción idiosincrásica.
- • La combinación valproico + topiramato se ha asociado con más frecuencia a hiperamonemia.
Toxicidad hematológica
- • Reacción adversa infrecuente.
- • Anemia aplásica con felbamato (127 casos por millón) y carbamazepina (5-20 casos por millón).
- • No asociar carbamazepina con felbamato por aumentar el riesgo.
- • Es frecuente encontrar leucopenia con carbamazepina y fenitoína sin que esto indique un mayor riesgo de toxicidad hematológica.
- • El ácido valproico se suele asociar con plaquetopenia que no suele ser clínicamente significativa.
Empeoramiento paradójico en el control de las crisis
- • Existe un grupo de pacientes en los que el FAE en vez de mejorar el cuadro clínico lo empora, provocando un aumento en el número de crisis, aparición de crisis diferentes o cambio en el patrón de las crisis.
- • Para minimizar el riesgo de este efecto adverso, se debe elegir el FAE en base al tipo de crisis y, fundamentalmente, al síndrome epiléptico que estemos tratando.
- • Más riesgo de este efecto adverso en:
- ◗ Pacientes con epilepsias focales benignas de la infancia.
- ◗ Pacientes con EGI.
- ◗ FAEs que bloquean el canal del Na+ y gabaérgicos.
Tabla X. Asociaciones de FAEs-tipo de crisis que pueden empeorar el control de la epilepsia.
|
FAE |
Síndrome/Tipo de crisis |
|
PHT, CBZ, OXC |
Ausencias, mioclonías, crisis atónicas y tónicas |
|
PB |
Ausencias |
|
VGB, TGB, GBP, PGB |
Ausencias, miclonías |
|
LTG |
Epilepsia mioclónica severa de la infancia |
|
CBZ, PB, LTG |
Epilepsia focal benigna de la infancia |
|
Benzodiazepinas |
Estado tónico en el Síndrome de Lennox-Gastaut |
|
CBZ, LTG |
Síndrome de Landau-Kleffner |
|
CBZ, PHT |
Epilepsia mioclónica progresiva |
Otros efectos adversos idiosincrásicos
- • Miopía aguda y pérdida de visión por glaucoma de ángulo cerrado: topiramato.
- • Lupus eritematoso: carbamazepina.
- • Pancreatitis: ácido valproico (la amilasa puede ser normal, es preferible solicitar la lipasa).
Reacciones adversas crónicas o tardías (tipo C)
- • Las reacciones adversas crónicas pueden involucrar múltiples órganos.
- • Muchas de estas reacciones son predecibles y algunas reversibles.
Peso
- • FAEs asociados con aumento de peso: ácido valproico, pregabalina, gabapentina, carbamazepina y vigabatrina.
- • Entre ellos, destaca el ácido valproico, existiendo una ganancia de peso dosis-dependiente y también influenciada por el peso basal del paciente (p. ej., es más frecuente el aumento de peso en los pacientes obesos que inician tratamiento con ácido valproico que en los pacientes delgados).
- • FAEs asociados a pérdida de peso: zonisamida, topiramato y felbamato. La pérdida de peso también es dosis dependiente y también está influenciada por el peso basal (p. ej., los pacientes obesos pierden más peso que los delgados cuando se inicia cualquiera de los tres fármacos).
Metabolismo óseo
- • Mayor riesgo de osteoporosis y fracturas con fármacos inductores enzimáticos (carbamazepina, fenitoina, fenobarbital, primidona) y con ácido valproico.
- • Mayor riesgo en mujeres mayores de 40 años que toman estos fármacos durante al menos dos años.
- • En pacientes que toman estos FAEs de forma crónica es recomendable realizar:
- ◗ Densitometrías óseas seriadas.
- ◗ Administrar suplementos de calcio, vitamina D y bifosfonatos si riesgo de osteoporosis.
- ◗ Es controvertido si se realizan análisis bioquímicos seriados con estudio de hormona paratiroidea, 25-OHD, calcio y fosfato.
Función sexual y reproductiva
- • El tratamiento crónico con ácido valproico, carbamazepina, fenitoína y barbitúricos se ha relacionado con un mayor riesgo de disfunción sexual e infertilidad en varones con epilepsia.
- • El ácido valproico se ha relacionado con un volumen testicular menor.
- • El ácido valproico se relaciona con mayor riesgo de alteraciones menstruales, síndrome de ovario poliquístico e hiperandrogenismo en mujeres.
Otros efectos adversos crónicos
- • Nefrolitiasis: zonisamida y topiramato. Mayor riesgo en pacientes que toman estos fármacos y dieta cetógena.
- • Pérdida de visión periférica: vigabatrina.
- • Trastornos de movimiento: fenitoina, carbamazepina, ácido valproico (temblor), gabapentina.
- • Atrofia cerebelosa en RM cerebral: fenitoína (controvertido).
- • Alteraciones de partes blandas (dupuytren, nódulos palmares, tendinitis): barbitúricos.
- • Alteraciones capilares (alopecia, adelgazamiento del pelo): ácido valproico.
- • Hiperplasia gingival: fenitoína.
Teratogénicos y carcinogénicos
Efectos teratogénicos
Ver "Efectos teratógenos" en el apartado de "Tratamiento farmacológico y mujer" del capítulo de "Tratamiento farmacológico".
Efectos carcinogénicos
- • En base a la experiencia adquirida con los FAEs clásicos (empleados durante décadas) no parece que exista un mayor riesgo de neoplasias en pacientes que reciben tratamiento crónico con FAEs.
- • Es controvertido si el uso crónico de fenitoína se asocia con un mayor riesgo de linfoma, y fenobarbital a mayor riesgo de tumores hepáticos y cerebrales.
- • No se ha establecido mayor riesgo de carcinogénesis en pacientes tratados con FAEs de nueva generación.
Interacciones farmacológicas (tipo E)
- • Se denomina interacción farmacológica a la modificación del efecto de un fármaco causado por la administración conjunta de otros fármacos.
- • Las interacciones entre los FAEs pueden ser responsables de que los fármacos sean menos eficaces o que el paciente presente toxicidad.
- • No obstante, otras interacciones pueden ser beneficiosas y se emplean habitualmente en la práctica clínica diaria.
- • El riesgo de interacción es mayor cuantos más FAEs combinemos y/o si se emplean antiepilépticos inductores/inhibidores enzimáticos.
Tipos de interacciones
Las interacciones más importantes clínicamente y que mejor conocemos son:
- • Inducción enzimática: los antiepilépticos inductores enzimáticos aumentan el metabolismo hepático de muchos otros fármacos, disminuyendo su concentración plasmática y, por tanto, su eficacia. Para que haya inducción, es necesario que los fármacos compartan la misma enzima y el FAE inductor sea capaz de inducir la síntesis. Este tipo de interacción aparece generalmente al cabo de los días-semanas de introducir el FAE inductor pudiendo existir: 1) pérdida de control en las crisis por disminución del FAE inducido, 2) toxicidad por la aparición de metabolitos activos incluso con niveles normales/disminuidos del FAE inducido, 3) al retirar el FAE inductor pueden existir toxicidad por rebote, con aumento de los niveles del FAE que inicialmente fue inducido, por lo que puede ser necesario reajustar la dosis. Los principales antiepilépticos inductores enzimáticos (AEIE) son: CBZ, PHT, PB y PRM.
- • Inhibición enzimática: a diferencia del otro tipo de interacción, la inhibición enzimática es dosis dependiente, y puede aparecer al cabo de las horas desde que el FAE inhibidor es asociado. La inhibición del metabolismo de un FAE por otro, favorece que aumenten drásticamente los niveles del FAE que es inhibido aumentando el riesgo de toxicidad. En esta situación puede ser necesario disminuir la dosis inicial del FAE que va a ser inhibido. El principal FAE inhibidor enzimático (AEInhE) es el VPA.
Interacciones entre FAEs antiepilépticos (Tabla XI).
Tabla XI. Interacciones entre FAEs antiepilépticos.
|
FAE inicial |
Efecto del FAE añadido sobre el FAE inicial |
Implicaciones clínicas relevantes |
|
CBZ |
⇓AEIE, ↓OXC, ↓FBM, ↓ ZNS, ⇑VPA |
|
|
CLB |
⇓AEIE, ⇑ stiripentol |
|
|
CZP |
⇓AEIE |
Menor nivel plasmático de CZP |
|
ESL |
↓AEIE |
No interacciones clínicamente significativas |
|
ESM |
⇓AEIE,↓↑VPA |
Menor nivel plasmático de ESM |
|
FBM |
⇓AEIE, ↑VPA, ↑GBP |
Menor nivel plasmático de FBM |
|
PHT |
↑ RFM, ↑↓ AEIE, ↑OXC, ↑TPM, ⇑FBM, ↓VGB, ↓VPA |
|
|
PB |
⇑VPA, ⇑FBM, ↑OXC, ↑stiripentol, ↑PHT |
Aumento de los niveles plasmáticos de PB cuando se asocia con VPA o FBM, con mayor riesgo de toxicidad |
|
GBP |
--- |
No interacciones clínicamente significativas |
|
LCM |
↓AEIE |
No interacciones clínicamente significativas |
|
LTG |
⇓AEIE, ↓OXC,⇑VPA |
|
|
LEV |
↓AEIE |
No interacciones clínicamente significativas |
|
OXC |
↓AEIE |
No interacciones clínicamente significativas |
|
PGB |
↓AEIE |
No interacciones clínicamente significativas |
|
PRM |
⇓AEIE |
Menor nivel plasmático de PRM con aumento del nivel de PB, con mayor riesgo de toxicidad |
|
RTG |
↓AEIE |
No interacciones clínicamente significativas |
|
RFN |
↓AEIE, ⇑VPA |
Aumento del nivel plasmático de RFM cuando se asocia con VPA, especialmente en niños <30 Kg, con mayor riesgo de toxicidad |
|
TGB |
⇓AEIE |
Menor nivel plasmático de TGB |
|
TPM |
⇓AEIE, ↓VPA |
Menor nivel plasmáticos de TPM |
|
VPA |
⇓AEIE,↓ETM, ↓TPM, ⇑FBM, ↑stiripentol |
Menor nivel plasmático de VPA |
|
VGB |
--- |
No interacciones clínicamente significativas |
|
ZNS |
⇓AEIE |
Menor nivel plasmático de ZNS |
Adaptada de la Guía Oficial de la SEN(31, 32).
⇓⇑: Disminución/aumento clínicamente significativo de la concentración plasmática del FAE inicial.
↓↑: Disminución/aumento sin relevancia clínica de la concentración plasmática del FAE inicial.
Interacción con otros fármacos no antiepilépticos
- • La mayoría de las interacciones son debidas a los FAEs inductores enzimáticos clásicos e inhibidores enzimáticos.
- • Muchas interacciones son impredecibles debido a:
- ◗ Variaciones genéticas.
- ◗ Reacciones paradójicas.
- ◗ Uso concomitante de otras sustancias no reportadas.
- • Cambios frecuentes y simultáneos de fármacos dificultan su interpretación.
Principales interacciones de los antiepilépticos según diferentes
grupos farmacológicos (Tabla XII).
Tabla XII. Principales interacciones de los antiepilépticos según diferentes grupos farmacológicos.
|
Grupo |
Efecto de los FAEs sobre la concentración del fármaco |
|
Aparato digestivo |
La famotidina y los inhibidores de la bomba de protones no suelen tener interacción con los FAEs |
|
Aparato respiratorio |
Teofilina ↓↓ con PHT |
|
Antimicrobianos |
Macrólidos, antifúngicos, antiparasitarios, metronidazol: ↓↓con AEIE Los antiretrovirales ↓ con AEIE y ↑ con VPA La CZP ↑↑ con la isoniazida Muchos antimicrobianos pueden provocar ↑↑ o ↓↓ de la PHT o un efecto variable leve de ↑ o ↓ (ciprofloxacino) |
|
Antineoplásicos |
Ciclofosfamida, etopóxido, metotrexate, paclitaxel, procarbazina, tamoxifeno, alcaloides de la vinca: ↓ con AEIE Valproato ↑ niveles de fotemustina, cisplatino y etopósido El valproato reduce leve, pero de forma estadísticamente significativa, la depuración de temodal |
|
Benzodiazepinas |
↓↓ con PHT y CBZ |
|
Bloqueantes |
↓↓ con PHT y CBZ |
|
Cardiovasculares |
Calcioantagonistas: ↓↓ con AEIE, betabloqueantes: ↓ con AEIE, cumarínicos (warfarina): ↓↓ con AEIE, digoxina: ↓↓ con CBP, inhibidores AraII: Inhibidores de los receptores de angiotensina II ↓ con AEIE, estatinas: ↓con AEIE, amiodarona: ↓↓ con PHT El VPA puede ↑ calcioantagonistas, cumarínicos, estatinas |
|
Inmunosupresores |
Corticoides, ciclosporina, tacrólimus: ↓↓ con AEIE. La OXC puede producir ↓ de estos fármacos Ciclofosfamida ↓ con AEIE Los corticoides pueden ↑↑ la PHT |
|
Metadona |
↓↓ con PHT y CBZ |
|
Narcóticos |
↓↓ con AEIE con riesgo de toxicidad por producción de metabolitos tóxicos |
↓ (descenso) o ↑ (aumento) sin probable repercusión.
↓↓ (descenso) o ↑↑ (aumento) importantes que requieren ajuste de dosis o monitorización de FAEs.
Efecto de otros fármacos sobre los FAEs
Fármacos que aumentan la concentración sérica de antiepilépticos (Tabla XIII)(24).
Tabla XIII. Fármacos que aumentan la concentración sérica de antiepilépticos.
|
Fármaco afectado |
Fármaco que precipita el efecto |
|
CBZ |
|
|
ESM |
|
|
LTG |
|
|
PB |
|
|
PHT |
|
|
Valproato |
|
Monitorización de los efectos adversos
- • Los niveles plasmáticos de FAEs intentan establecer un rango farmacológico donde es más probable que exista mayor control de crisis con menor riesgo de toxicidad.
- • La mayoría de los niveles de fármacos antiepilépticos son orientativos. El manejo final del paciente dependerá de la respuesta clínica, de los posibles efectos adversos, independientemente del valor del nivel plasmático.
- • La mayoría de los antiepilépticos más modernos no precisan monitorización de niveles plasmáticos.
- • Si se solicita la determinación, ésta tiene más valor clínico si se realiza a primera hora de la mañana, salvo para FAEs con vida media larga (ej. fenobarbital).
- • Es recomendable esperar a que el paciente haya recibido varias dosis del fármaco para que el FAE se encuentre en un equilibrio estable (el equivalente a 4-5 semividas del FAE).
Niveles plasmáticos de referencia (Tabla XIV)
Tabla XIV. Niveles plasmáticos de referencia.
|
FAE |
Niveles plasmáticos (mg/mL) |
|
CBZ |
4-12 |
|
CLB |
0,03-03 |
|
CZP |
0,02-0,07 |
|
ESL |
No establecido |
|
ESM |
40-100 |
|
FBM |
30-60 |
|
GBP |
2-20 |
|
LCM |
No establecido |
|
LTG |
2,5-15 |
|
LEV |
12-46 |
|
OXC |
3-35 |
|
PB |
10-40 |
|
PHT |
10-20 |
|
PGB |
No establecido |
|
PRM |
5-10 |
|
RTG |
No establecido |
|
RFN |
No establecido |
|
TGB |
0,02-0,2 |
|
TPM |
5-20 |
|
VPA |
50-100 |
|
VGB |
0,8-36 |
|
ZNS |
10-40 |
Adaptada de la Guía Oficial de Epilepsia de la SEN(32).
¿Cuándo se ha de solicitar la monitorización de antiepilépticos?
Hay determinadas circunstancias en las que la determinación de los niveles plasmáticos de los FAEs puede ayudar a mejorar el control de las crisis epilépticas en un paciente:
- • Mal control de crisis epilépticas o crisis recurrentes.
- • Sospecha de mala adherencia al tratamiento.
- • Sospecha de toxicidad por un FAE, sobre todo, si recibe politerapia.
- • Pacientes con enfermedades hepáticas, renales o situaciones en las que puede modificarse la farmacocinética de un fármaco.
- • Al asociar fármacos con alto riesgo de interacción.
- • Para conocer el rango terapéutico individual.
Recomendaciones de actuación según niveles del FAE (Tabla XV)
Tabla XV. Recomendaciones de actuación según niveles del FAE.
|
Situación clínica |
Efectos |
Niveles del FAE |
Recomendación
|
|
Controlado |
No |
Infra o supraterapeúticos |
No hacer nada |
|
Controlado |
Sí |
Infra o supraterapéuticos |
Reducir FAE |
|
Respuesta parcial |
No |
Infra o supraterapéuticos |
Valorar aumentar FAE |
|
Respuesta parcial |
Sí |
Infra o supraterapéuticos |
Reducir FAE, se puede valorar otro FAE si niveles infraterapéuticos |
|
No |
Sí No |
Infra o supraterapéuticos |
Cambio de FAE |
Adaptada de la Guía Oficial de Epilepsia de la SEN(32).
Bibliografía
1. Kwan P, Brodie MJ. Early identification of refractory epilepsy. NEJM. 2000;342: 314-9.
2. Medical Research Council Antiepileptic Drug Withdrawal Study Group. Randomised study of antiepileptic drug withdrawal in patients in remission. Lancet. 1991;337:1175-80.
3. Shorvon S. Principles of Treatment. En: Handbook of Epilepsy Treatment. 3rd ed. Wiley-Blackwell; 2010. p. 105.
4. Schiller Y, Najjar Y. Quantifying the response to antiepileptic drugs. Effect of past treatment history. Neurology. 2008; 70:54-65.
5. Kwan P, Arzimanoglou A, Berg AT, Brodie MJ, Allen Hauser W, Mathern G, et al. Definition of drug resistant epilepsy: Consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia. 2010:51:1069-77.
6. Chiron C, Marchand MC, Tran A, Rey E, d'Athis P, Vincent J, et al. Stiripentol in severe myoclonic epilepsy in infancy: a randomised placebo-controlled syndrome-dedicated trial. STICLO study group. Lancet. 2000;356:1638-42.
7. Brodie MJ, Covanis A, Gil-Nagel A, Lerche H, Perucca E, Sills GJ, White HS. Antiepileptic drug therapy: does mechanism of action matter?. Epilepsy Behav. 2011;21(4):331-41.
8. Giménez JR, Sánchez-Alvarez JC. Tratamiento combinado con FAE. En: Diagnóstico y tratamiento de la epilepsia en niños y adultos. Guía Andaluza de Epilepsia 2009. EMISA; 2009. p. 305-16.
9. Brodie MJ, Sills GJ. Combining antiepileptic drugs- Rational polytherapy?. Seizure. 2011;20:369-75.
10. Armijo JA, Herranz JL. Politerapia racional en epilepsia. III. Posibles asociaciones de antiepilépticos. Rev Neurol. 2007:45(4):236-44.
11. Husain A, Chung S, Faught E, Isojarvi J, McShea C, Doty P. Long-term safety and efficacy in patients with uncontrolled partial-onset seizures treated with adjunctive lacosamide: results from a Phase III open-label extension trial. Epilepsia. 2012;53(3):521-8.
12. Gil-Nagel A, Marin H. Lacosamide: a new generation in the treatment of epilepsy. Rev Neurol. 2011;52:159-62.
13. Fattore C, Perucca E. Novel medications for epilepsy. Drugs. 2011;71:2151-78.
14. Caplin DA, Rao JK, Filoux F, Bale JF, Orman CV. Development of performance indicators for the primary care management of pediatric epilepsy: expert consensus recommendations based on the available evidence. Epilepsia. 2006;47:2011-9.
15. Actitud terapéutica en el niño. En Guía oficial para el diagnóstico y tratamiento de la epilepsia 2008. Ed Prous Science S.A.U; 2008. p. 175-81.
16. Muthugovindan D, Hartman AL. Pediatric epilepsy syndromes. Neurologist. 2010;16:223-37. Review.
17. Ilo E, Leppik Cur. Treatment of epilepsy in the elderly. Treat Options Neurol. 2008;10(4):239-45.
18. Faught E. Monotherapy in adults and elderly persons. Neurology. 2007;69(24 Suppl 3):S3-9.
19. Actitud terapéutica en el anciano. Guía oficial para el diagnóstico y tratamiento de la epilepsia. SEN; 2008. p. 189-94.
20. Eurap Study Group: Seizure control and treatment in pregnancy: observations from the EURAP epilepsy pregnancy registry. Neurology. 2006;66:354-60.
21. Weil S, Deppe Ch, Noachtar S. The treatment of women with epilepsy. Dtsch Arztebl Int. 2010;107(45):787-93.
22. Morrow J, Russell A, Guthrie E, Parsons L, Robertson I, Waddell R, et al. Malformation risks of antiepileptic drugs in pregnancy: a prospective study from the UK Epilepsy and Pregnancy Register. J Neurol Neurosurg Psychiatry. 2006;77:193–8.
23. Harden CL, Meador KJ, Pennell PB, Hauser WA, Gronseth GS, French JA, et al. Practice parameter update: management issues for women with epilepsy: focus on pregnancy (an evidence-based review): teratogenesis and perinatal outcomes: report of the Quality Standards Subcommittee and Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology and American Epilepsy Society. Neurology. 2009;73:133–41.
24. Rivas J, Doval O, Kanner AM. Aspectos psiquiátricos de las epilepsias. En Epilepsias Diagnóstico y tratamiento. Ed Mediterráneo; 2004. p. 776-94.
25. Kerr MP, Mensah S, Besag F, de Toffol B, Ettinger A, Kanemoto K, et al. International consensus clinical practice statements for the treatment of neuropsychiatric conditions associated with epilepsy. Epilepsia. 2011;52:2133-8.
26. Ruiz-Giménez J, Sánchez- Álvarez JC, Cañadillas-Hidalgo F, Serrano-Castro P. Antiepileptic treatment in patients with epilepsy and other comorbidities. Seizure. 2010;10375-82.
27. Glauser T, Ben-Menachem E, Bourgeois B, Cnaan A, Chadwick D, Guerreiro C, et al. ILAE treatment guidelines: evidence-based analysis of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes. Epilepsia. 2006;47:1094-120.
28. Kwan P, Brodie MJ. Effectiveness of first antiepileptic drug. Epilepsia. 2001;42(10): 1255-60.
29. Birbeck GL, French JA, Perucca E, Simpson DM, Fraimow H, et al. Antiepileptic drug selection for people with HIV/AIDS. Evidence-based guidelines from the ILAE and AAN. Epilepsia. 2012;53:207–14.
30. Perucca E, Meador JK. Adverse events of antiepileptic drug. Acta Neurol Scand Suppl. 2005;181:30-5.
31. Interacciones de los fármacos antiepilépticos. Guía oficial para el diagnóstico y tratamiento de la epilepsia 2008. SEN. Ed Prous Science, S.A.U; 2008. p. 303-12.
32. Toledano R. Guías SEN. En prensa.